Karbon kararlı hale gelmek için son yörüngesinde 8 e- olmalı yani 4 e- a ihtiyacı vardır. Bu yüzden karbon, oksijen atomlarıyla kovalent bağ yapar. Birbirlerinin elektronlarını ortak kullanarak kararlı olur. Dikkat edilirse CO2 molekülünün kovalent bağlı yapısında her bir atomun çevresinde toplam 10 elektron vardır. Yani hepsi kararlıdır.
Bileşik formülleri:
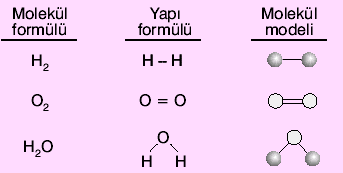
Bileşikler kimyasal formüllerle gösterilir. Formüller, bileşik molekülündeki atomların cinsini ve sayısını gösterir.
Bir bileşik molekülündeki atomların cinsi ve sayısının gösterimine molekül formülü denir. Atomların birbirine nasıl bağlandığını gösteren formüle de yapı formülü denir.
Bileşik formüllerinin yazılması
Bileşiklerin formülü yazılmadan önce, bileşiği oluşturan elementlerin iyon yükü bulunur ve elementlerin sağ üst köşelerine yazılır. Ardından çaprazlama yapılarak, iyon yükleri sembollerin sağ altına yazılır. Burada dikkat edileceği gibi önce (+) yüklü sonra (–) yüklü iyon yazılarak çaprazlanır. Ve yüklerin sadece rakamları yazılır. İşaretleri yazılmaz.

Eğer a ve b birbirine eşitse sembollerin altına sayı yazılmaz. Mg+2 O–2 = MgO daki gibi.
Örnek: X+3 ile Z–2 iyonlarının oluşturacağı bileşiğin formülünü yazınız.
Örnek: Mg+2, Cl–1 iyonlarının oluşturacağı bileşiğin formülünü yazınız.
Kovalent Bağ Çeşitleri
O == O  O2 O2
Azot ( 7N ) ise kararlı yapıya ulaşmak için 3 elektrona ihtiyaç duyar. İki azot arasında 3`er elektron ortaklaşa kullanılarak kovalent bağ oluşur.
N ==N  N2 N2
POLAR KOVALENT BAĞ
HCl, H2O, NH3 gibi moleküller farklı cins atomlardan oluşmuş moleküllerdir. Burada atomların çekirdekleri farklı büyüklükte olduğundan ortaklaşa kullanılan elektronlara uygulanacak çekim kuvveti de farklı olacaktır.
Örneğin; H`nin 1 protonu varken O`nun 8 protonu vardır. H ile O arasında ortaklaşa kullanılan elektronlar oksijen tarafına daha çok çekilir. Bu durumda oksijen tarafında (–) yük miktarı artacak, hidrojen tarafında ise azalacaktır. Böylece çok çeken (oksijen) kısmen negatif, az çeken (hidrojen) kısmen pozitif yüklü olur. Yani molekülde bir kutuplaşma olur. Elektronların farklı miktarda çekilmesi sonucu meydana gelen bağa polar (kutuplu) kovalent bağ adı verilir. HCl, H2O, NH3 `te polar kovalent bağ vardır.
APOLAR KOVALENT BAĞ
O2, N2, H2 molekülleri aynı cins atomlardan oluşmuş iki atomlu moleküllerdir. Bu moleküllerde ortaklaşa kullanılan elektronlar her iki atom çekirdeği tarafından eşit oranda çekilir. Çünkü atomlar birbirinin aynıdır. Bu şekilde atomlar arasında elektronların eşit oranda çekilmesiyle oluşan bağa apolar kovalent bağ denir. Apolar bağ kutupsuz bağ demektir.
  
|