|
|
 Atom nedir? "Maddenin en küçük yapıtaşı! Peki, "madde" nedir? Elle tutup gözle gördüğümüz her şey! Aslında, doğru olmasına doğru bu yanıtların hepsi ama biraz eksik... Örneğin ben bir maddeyim; yani benim de en küçük yapıtaşım atomlar. Yani atom denen minik "yaratıklar"dan oluştum. Aynı şekilde yediğimiz elma, oturduğumuz sandalye, yazı yazdığımız kalem ve hatta onun mürekkebi, içtiğimiz su, soluduğumuz hava... Bunların hepsi madde ve hepsi de atomlardan oluşmuş. Peki nedir bu atom? Etrafımızda gördüğümüz tüm maddelerden sorumlu bu "minik" nesneler neye benzer? Herşeyden önemlisi, acaba onların da yapıtaşları var mı? Atom nedir? "Maddenin en küçük yapıtaşı! Peki, "madde" nedir? Elle tutup gözle gördüğümüz her şey! Aslında, doğru olmasına doğru bu yanıtların hepsi ama biraz eksik... Örneğin ben bir maddeyim; yani benim de en küçük yapıtaşım atomlar. Yani atom denen minik "yaratıklar"dan oluştum. Aynı şekilde yediğimiz elma, oturduğumuz sandalye, yazı yazdığımız kalem ve hatta onun mürekkebi, içtiğimiz su, soluduğumuz hava... Bunların hepsi madde ve hepsi de atomlardan oluşmuş. Peki nedir bu atom? Etrafımızda gördüğümüz tüm maddelerden sorumlu bu "minik" nesneler neye benzer? Herşeyden önemlisi, acaba onların da yapıtaşları var mı?
Aslına bakarsanız, bu sorular yüzyıllar öncesinden de sorulmuş. Hatta "atom" sözcüğünün ilk ortaya çıkışı İ.Ö. 460 yılına kadar uzanıyor. O dönemde yaşamış Demokritus adlı bir filozof, bir elmayı örnek vererek atomu ve anlamını açıklamış: Bir elma alın ve onu ikiye bölün. Sonra bu yarım elmalardan birini tekrar ikiye bölün ve böylece sürdürün... Demokritus`a göre, bu şekilde yarım parçaları bölmeye devam ederseniz, sonunda öyle bir an gelecek ki, artık bölemeyeceğiniz kadar küçük bir parça elde edeceksiniz (ama bıçağınız kesemediği için değil, bölmek mümkün olmadığı için!). İşte, bölünmesi olanaksız bu parçaya Demokritus Yunanca`da `bölünemez" anlamına gelen "atomos" adını vermiş.
Demokritus, bu kavramı ortaya atmış atmasına ama bunu o dönemin diğer bilim adamlarına inandıramamış. Özellikle de dönemin en büyük filozofu Aristo`ya. Zaten Aristo reddedince, bir bildiği vardır diye diğerleri de inanmamış. Hatta Demokritus öldükten yüzyıllar sonra bile kimse atomdan bahsetmemiş.
Ta ki, 2000 yıl kadar sonraya, yani 1800`li yılların başına kadar. Bilim adamları maddenin doğasını anlamaya yönelik çalışmaları sırasında ister istemez bu minik parçacıklarla karşılaşmışlar. İngiliz bilim adamı Dalton, deneyleri sırasında, maddeyi oluşturan ama yapısını tanımlayamadığı bu temel ögelere ilişkin ilk kanıtları elde etmiş. Ondan sonra da keşifler ardı sıra devam etmiş.
 Atomun varlığı kanıtlandıktan sonra da, yapısını anlamaya yönelik bir çok kuram ortaya atılmış. Bunlardan ilki J. J. Thomson adlı bir İngiliz fizikçi`den geliyor. Atomun varlığı kanıtlandıktan sonra da, yapısını anlamaya yönelik bir çok kuram ortaya atılmış. Bunlardan ilki J. J. Thomson adlı bir İngiliz fizikçi`den geliyor.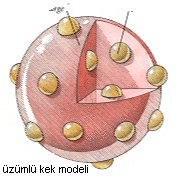
Thomson, 1897 yılında atomun bir parçası olan eksi yüklü elektronları keşfetmiş. Thomson`a göre atomun içinde eksi yüklü elektronları dengeleyecek artı yüklü parçacıklar olması gerekiyordu. Thomson, atomu bir "üzümlü kek"e benzetmişti: Üzümler eksi yüklü elektronlar, kekin diğer kısımları ise artı yüklü madde.
Bundan daha doğru bir modeli, 1911 yılında atomun içinde artı yüklü bir çekirdeğin 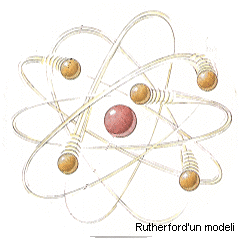 olması gerektiğini keşfeden Ernest Rutherford geliştirmiş. Rutherford`un atom modeli, Güneş Sistemi`mizin yapısına benziyor. Ortada Güneş, yani artı yüklü çekirdek ve çevresinde dolanan gezegenler, yani eksi yüklü elektronlar. Rutherford`un bu modeline göre çekirdek atomun çok küçük bir parçası: Örneğin atomun boyutunu Dünya kadar büyütsek bile içindeki çekirdek en fazla bir futbol stadyumu kadar kalıyordu. Rutherford daha da olması gerektiğini keşfeden Ernest Rutherford geliştirmiş. Rutherford`un atom modeli, Güneş Sistemi`mizin yapısına benziyor. Ortada Güneş, yani artı yüklü çekirdek ve çevresinde dolanan gezegenler, yani eksi yüklü elektronlar. Rutherford`un bu modeline göre çekirdek atomun çok küçük bir parçası: Örneğin atomun boyutunu Dünya kadar büyütsek bile içindeki çekirdek en fazla bir futbol stadyumu kadar kalıyordu. Rutherford daha da
önemli bir adım atarak, çekirdek içinde artı yüklü parçacıkları yani protonları keşfetmiş ve protonların elektronlardan 1836 kez daha ağır
olduğunu bulmuş.
Fakat bu model de bazı kuramsal sorunlar çıkarmış. 1912 yılında Danimarkalı fizikçi  Niels Bohr, bu kuramsal sorunları çözecek bir model oluşturmuş. Bohr`un atom modelinde, yine ortada artı yüklü bir çekirdek, fakat sadece belli yörüngelerde dolanabilen eksi yüklü elektronlar var. Bundan sonraki gelişmeler, Bohr`un atom modelini düzeltmeye yönelik. Bu gelişmelerden biri, çekirdekte artı yüklü proton dışında, yüksüz "nötron" adı verilen parçacıkların da olduğu. Nötronları da 1932 yılında, James Chadwick, kendisinin yaptığı derme çatma bir detektörle keşfetmiş. Niels Bohr, bu kuramsal sorunları çözecek bir model oluşturmuş. Bohr`un atom modelinde, yine ortada artı yüklü bir çekirdek, fakat sadece belli yörüngelerde dolanabilen eksi yüklü elektronlar var. Bundan sonraki gelişmeler, Bohr`un atom modelini düzeltmeye yönelik. Bu gelişmelerden biri, çekirdekte artı yüklü proton dışında, yüksüz "nötron" adı verilen parçacıkların da olduğu. Nötronları da 1932 yılında, James Chadwick, kendisinin yaptığı derme çatma bir detektörle keşfetmiş.
Atomun tam bir modelini oluşturmadaki en önemli yöntem, Kuantum Mekaniği adı verilen fizik dalının gelişmesiyle oldu. Bugünkü bilgilerimizin tamamı bu fizik dalının gelişmesiyle elde edildi. Artık bugün atom ve yapısı hakkında epeyce bilgiye sahibiz. Kuantum kuramına göre, atom, artı yüklü bir çekirdek ve etrafında dalga gibi de hareket edebilen elektronların bulutundan oluşan minik bir "nesne"... 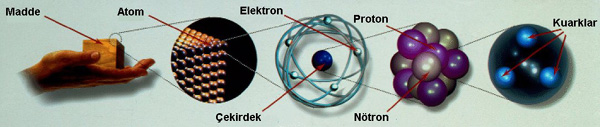
Atomdan Öte Köy Var Mı?
Aslında, atomlar her ne kadar maddenin yapıtaşları olarak tanımlansa da, gördüğümüz gibi onların da daha küçük yapıtaşları var. Demokritus`un elma örneğinde bir bıçak değil de, günümüzün modern mikroskoplarını kullandığımızı  düşünelim. Tabii ki, elmayı keserek değil, büyüterek yapabiliriz bunu. Elmanın bir parçasının görüntüsünü mikroskop altında büyütelim. Önce elmanın detaylarına, daha büyütmeye devam edersek molekül adını verdiğimiz atom gruplarına ulaşırız. Moleküller, iki ya da daha fazla atomun "kimyasal bağ" adı verilen işlemle biraraya gelmesi sonucu oluşur. İşte, madde dediğimiz nesnelerin katı (elma gibi), sıvı (su gibi) veya gaz (hava gibi) olmasını sağlayan şey, bu moleküllerin biraraya geliş biçimi. Moleküller birbirleriyle çok sıkı sıkıya bağlanmış ve yerlerinden kıpırdayamıyorlarsa madde katı halde; atomlar, düşünelim. Tabii ki, elmayı keserek değil, büyüterek yapabiliriz bunu. Elmanın bir parçasının görüntüsünü mikroskop altında büyütelim. Önce elmanın detaylarına, daha büyütmeye devam edersek molekül adını verdiğimiz atom gruplarına ulaşırız. Moleküller, iki ya da daha fazla atomun "kimyasal bağ" adı verilen işlemle biraraya gelmesi sonucu oluşur. İşte, madde dediğimiz nesnelerin katı (elma gibi), sıvı (su gibi) veya gaz (hava gibi) olmasını sağlayan şey, bu moleküllerin biraraya geliş biçimi. Moleküller birbirleriyle çok sıkı sıkıya bağlanmış ve yerlerinden kıpırdayamıyorlarsa madde katı halde; atomlar,  kopmamak şartıyla birbirleri etrafında hareket edebiliyorlarsa sıvı halde; atomların oluşturduğu moleküller serbestçe hareket edebiliyorlarsa gaz halinde oluyor. kopmamak şartıyla birbirleri etrafında hareket edebiliyorlarsa sıvı halde; atomların oluşturduğu moleküller serbestçe hareket edebiliyorlarsa gaz halinde oluyor.
Demek ki, biraz daha büyütürsek atomlara ulaşacağız. Tanımımız gereği, atomlar madde değil. Çünkü madde olabilmesi için en azından katı, sıvı veya gaz halinde olabilmeli. Fakat, bu hallerden birisi için kimyasal bir bağa, yani en az iki atoma gereksinim var. Dolayısıyla tek başına bir atom ne katı, ne sıvı, ne de gaz yani ne de madde. Ancak biraraya gelirlerse madde oluşturuyorlar. Bu anlamıyla maddenin yapıtaşı! Atomu, mikroskobumuzda büyütmeye devam ettiğimizde (aslında bunu yapabilecek mikroskoplar yok, fakat bilim adamları başka işlemlerle bunu yapabiliyorlar. Biz yine de yapabildiğimizi varsayalım) başta da söylediğimiz gibi, Güneş Sistemi`ne benzer bir yapıyla karşılaşıyoruz. Ortada bir çekirdek ve etrafında dolanan elektronlar. Elektron bulutundan geçip içeri dalıyoruz ve merkezde yer alan çekirdeği görüyoruz. Büyütmeye devam ediyoruz ve çekirdeğin içine bakıyoruz. Burada nötron ve protonlarla karşılaşıyoruz.
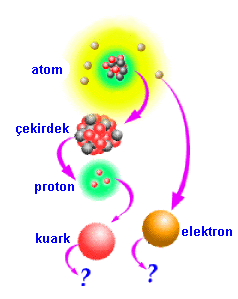 Elektronlar eksi yüklü ve hafif, protonlar artı yüklü ve ağır, nötronlar ise yüksüz ve ağır parçacıklar. Yük ve kütle gibi kavramlar atomları birbirinden ayırdetmekte kullanılıyor. Çünkü çok sayıda atom var ve bunların hepsinin, elektron, proton ve nötron sayıları farklı. Bir atomdaki elektronların sayısı, o atomun atom numarasını (AN) veriyor, bu sayı aynı zamanda o atomun çekirdeğindeki proton sayısına da eşit. Proton ve nötron sayılarının toplamı ise atomun kütle numarasını (KN) veriyor. Örneğin en basit yapıya sahip atomlardan biri olan helyumun atom numarası 2 ve kütle numarası 4 (yani 2 proton, 2 elektron ve 2 nötronu var) ve 4He2 şeklinde simgeleniyor. Havada bulunan oksijen atomunun ise atom numarası 8 ve kütle numarası 16 vb... Elektronlar eksi yüklü ve hafif, protonlar artı yüklü ve ağır, nötronlar ise yüksüz ve ağır parçacıklar. Yük ve kütle gibi kavramlar atomları birbirinden ayırdetmekte kullanılıyor. Çünkü çok sayıda atom var ve bunların hepsinin, elektron, proton ve nötron sayıları farklı. Bir atomdaki elektronların sayısı, o atomun atom numarasını (AN) veriyor, bu sayı aynı zamanda o atomun çekirdeğindeki proton sayısına da eşit. Proton ve nötron sayılarının toplamı ise atomun kütle numarasını (KN) veriyor. Örneğin en basit yapıya sahip atomlardan biri olan helyumun atom numarası 2 ve kütle numarası 4 (yani 2 proton, 2 elektron ve 2 nötronu var) ve 4He2 şeklinde simgeleniyor. Havada bulunan oksijen atomunun ise atom numarası 8 ve kütle numarası 16 vb...
Daha sonuna gelmedik. Son bir gayretle proton ve nötronun da içine bakıyoruz ve orada da daha temel parçacıklar görüyoruz. Bunlara da "kuark" adı veriliyor. İşte, maddenin içine yolculuğumuzun "şimdilik" son durağı burasıymış gibi görünüyor. Buradan daha ileri gitmemiz mümkün değil.
Artık bir sonuç çıkarabiliriz: Maddenin en küçük yapıtaşı kuarklar. Kuarklar bir araya gelerek proton ve nötronları, bunlar ve elektronlar biraraya gelerek atomları, atomlar molekülleri, moleküller de maddeyi (elma örneği gibi) oluşturuyor.
Gördüğümüz kadarıyla atomdan öteye köy var, yani kuarklar! Peki kuarklardan öteye? Bunu henüz bilemiyoruz. Ancak bu, hiç bilemeyeceğimiz anlamına gelmiyor. Demokritus`tan bugüne katettiğimiz yol, bilimin, her alanda olduğu gibi, maddenin temel yapısını anlamada da bize vereceği daha pek çok şey olduğunun bir göstergesi.
|
|
|
Bu konu 65609 kez okundu |
|
Bu konuyu Site Admini Ekledi |