MADDENİN
HALLERİ VE ISI
Isı : Maddeleri oluşturan tanecikler hareketli olup bu hareketlerinde
dolayı hareket enerjisine sahiptirler. Maddeyi oluşturan taneciklerin hareket
enerjileri toplamına ısı denir.
Isı; sıcaklıkları farklı iki madde arasında alınıp verilen enerjinin adıdır. Isı bir enerji türüdür. Q ile gösterilir . Isı büyüklüğü kalorimetre kabı ile ölçülür. Birimi joule ya da caloridir.
Sıcaklık: Maddeyi oluşturan taneciklerin ortalama hareket enerjileri
göstergesidir.
Sıcaklık bir enerji türü değildir. Isı miktarını anlatmak için kullanılır. t ile
gösterilir. Sıcaklık termometre ile ölçülür. Birimi derecedir.
Isı ve sıcaklık farklı kavramlar olmalarına rağmen birbirleri ile ilişkili
kavramlardır.
İki maddeden birinin sıcaklığının diğerinden farklı olması hâlinde, sıcaklığı
yüksek olan maddeden sıcaklığı düşük olan maddeye enerji aktarılır , bu
olaya ısı alışverişi denir.
Isı alışverişi şartı :
*** Maddeler farklı sıcaklıkta
olmalıdır.
*** Isı veren maddenin sıcaklığı düşer, ısı alan maddenin sıcaklığı artar.
*** Maddeler özdeş ise son sıcaklıkları eşit olur. Son sıcaklık maddelerin
sıcaklıklarının ortalaması alınarak bulunur.
Isı Sıcaklık İlişkisi :
*** Isı enerjisi yüksek olan maddeler sıcak ; ısı enerjisi düşük olan maddeler
soğuk olarak nitelendirilirler.
*** Kütleleri eşit olan maddelerden sıcaklığı yüksek olanın ısı sı da yüksektir.
*** Sıcaklık ve kütleleri eşit olan maddelerin ısıları da eşittir.
*** Isı alan maddelerin sıcaklığı artar; ısı veren maddelerin sıcaklığı düşer.
*** Kütlesi az olan maddeleri sıcaklığını artırmak ; kütlesi çok olan maddelerin
sıcaklığını artırmaktan daha kolaydır. ( Örneğin bir cezve suyu kaynatmak bir
çaydanlık suyu kaynatmaktan daha kolaydır)
ENERJİ DÖNÜŞÜMÜ VE ÖZISI
*Isı bir enerji çeşidi olduğuna göre maddelerin ısınması da enerji aktarımı ile
gerçekleşir.
*Bir gram maddenin sıcaklığını 1 0C arttırmak için gerekli ısı
miktarına o maddenin öz ısısı denir.
*Isı birimi olan “kalori” suyun öz ısısı esas alınarak tarif edilmiştir.
1 g suyun sıcaklığını1 0C arttırmak için gerekli ısı miktarı 1 kaloridir.
*Öz ısı cal/g 0C veya J/g 0C birimleriyle ifade edilir.(1
cal=4,18 joule ise suyun öz ısısı 4,18 J/g 0C olur)
* Öz ısı madde miktarına bağlı olmayıp maddenin cinsine bağlıdır ve tüm maddeler
için farklıdır. Bu yüzden öz ısı maddeler için ayırt edici bir özelliktir ve c
sembolü ile gösterilir.
Q = m . c. Δt
Q = Alınan ya da verilen ısı m = Kütle c= Özısı Δt= Sıcaklık farkı
Hal Değiştirme ve Isı
*** Isı alan saf maddeler belirli sıcaklıklara ulaştıkların hal değiştirirler.
Hal değiştirme maddenin tanecikleri arasındaki uzaklığın artması ya da azalması
sonucu gerçekleşir.
Erime : Katı maddenin sıvıya dönüşmesi
Donma: Sıvı maddenin katı
olması
Buharlaşma : Sıvı maddenin
gaza dönüşmesi
Yoğunlaşma: Gaz maddelerin
sıvıya dönüşmesi
Süblimleşme: Katı maddenin
sıvı olmada gaz hale geçmesi
Kırağılaşma : Gaz maddenin
sıvı olmadan katıya dönüşmesi
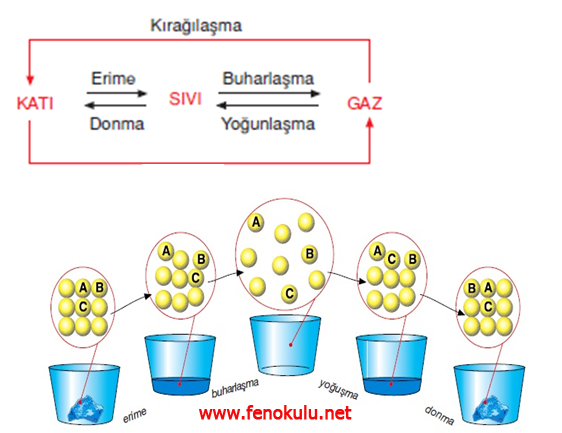
Bir maddede katı halden gaz hale doğru gidildikçe:
- Tanecikler birbirinden uzaklaşır.
- Tanecikler arasındaki çekim kuvveti azalır.(Gazlarda yok denecek kadar az)
- Taneciklerin hareket enerjisi artar ve tanecikler hızlanır.
- Tanecikler düzensizleşir. Şekil, hacim gibi özellikler ortadan kalkar.
- ERİME – DONMA ve BUHARLAŞMA – YOĞUŞMA ISISI
- * Katı maddeler erirken çevresinden ısı alır ve alınan ısıyı erime sıcaklığına
gelmek ve tamamen erinmek için kullanırlar.
- *Katı madde erimeye başladığı an sıcaklık bir süre sabit kalır, çünkü alınan
ısı katının tamamen erimesi için kullanılır. Sıcaklığın sabit kaldığı bu sürede
verilen ısı o maddenin erime ısısıdır.
- *Erime ısısı erime sıcaklığındaki 1 gram saf katı maddeyi sıvı hâle
geçiren ısıdır. Her madde için farklı olduğundan maddeler için ayırt edici bir
özelliktir ve Le gösterilir. Birimi J/g dır.
- * Maddenin donmak için dışarıya vermesi gereken ısıya ise donma ısısı denir. Madde donarken geçen sürede sıcaklık yine sabit kalır. Madde erimek için
aldığı ısı ne kadarsa, donmak için aynı ısıyı geri vermek zorundadır: Bu yüzden
erime ısısı donma ısısına eşittir. (Le =Ld)
- * Maddenin erimeye başladığı sıcaklığa erime noktası, donmaya başladığı
sıcaklığa ise donma noktası denir. Erime ve donma noktası maddeler için ayırt
edici bir özelliktir. Aynı madde için erime ve donma noktası birbirine eşittir.
(Erime noktası = Donma noktası) Örneğin su sıfırın üstünde sıvı, sıfırın altında
katıdır.(buz)
- * Aktarılan ısı kütle ile doğru orantılı olarak artar veya azalır. O halde bir
miktar maddeyi eritmek için gerekli ısı; Q= m.Le ile donması için dışarı vermesi
gereken ısı Q= m.Ld ile hesaplanır.
- *Sıvı haldeki madde buharlaşma sıcaklığına geldiğinde sıcaklık sabit
kalır.Çünkü verilen ısı maddenin tamamının gaz hale geçmesi için harcanmıştır.
- * Kaynama sıcaklığındaki 1 g saf sıvıyı, aynı sıcaklıktaki 1g buhar hâline
getirmek için gerekli ısıya buharlaşma ısısı denir. Sıvılar buharlaşırken
aldıkları ısıyı yoğuşurken geri verirler. Bu sebeple buharlaşma ısısı yoğuşma
ısısına eşittir. Buharlaşma ısısı Lb, yoğuşma ısısı Ly şeklindedir ve Lb=Ly
dir.
- * Farklı maddeler farklı buharlaşma - yoğuşma ısısına sahiptir. Bu sebeple
buharlaşma - yoğuşma ısıları da maddeler için ayırt edici bir özelliktir.
- * Sıvıların buharlaşması için gereken ısı miktarı kütleleriyle doğru
orantılıdır. Kaynama sıcaklığındaki “m” gram sıvıyı buharlaştırmak için gerekli
ısı Q= m.Lb bağıntısı ile , “m” gram buharın yoğuşarak sıvı hâle geçmesi için
çevresine verdiği toplam enerji miktarı Q= m.Ly bağıntısı ile hesaplanır.
- * Maddelerin buharlaşırken çevreden ısı alması ve yoğuşurken çevreye ısı
vermesi, günlük hayatta birçok alanda karşımıza çıkmaktadır.
Buzdolabına konulan yiyeceklerin
sulanması,
Yazın yolların ve mağaza önlerinin
sulanması,
Kesildikten sonra güneşe konulan
karpuzun soğuması,
Kolonya dökülen elin bir müddet sonra
serinlemesi
buna örnektir.
- * Saf maddelerin belirli bir erime ve kaynama noktaları vardır, fakat saf
olmayan maddelerin belirli bir erinme ve kaynama noktaları yoktur. Bu yüzden saf olmayan maddelerde kaynama süresince sıcaklık sabit kalmaz.
Örneğin suya tuz atıldığında
oluşan karışımda sodyum ve klor iyonları su moleküllerinin arasına girer ve
suyun donma noktasını düşürür. Kışın yollara tuz dökülmesinin sebebi budur.
- *Sıvılara karışmış olan katkı maddeleri ise sıvının kaynama sıcaklığını
yükseltir. Örneğin suya tuz atıldığında kaynama noktası yükselecektir. Bu yüzden
yemeklere atılan tuz, piştikten sonra atılırsa daha mantıklı bir karar verilmiş
olacaktır.
Isınma – Soğuma Eğrileri
*** Maddeler ısı aldıklarında sıcaklıkları artar.Saf maddeler belirli
sıcaklıklara ulaştıklarında hal değiştirirler. Saf maddelerin hal değiştirme
süresince sıcaklıkları değişmez.
*** Maddeler ısı verdiklerinde sıcaklıkları azalır. Saf maddeler belirli
sıcaklıklara ulaştıklarında hal değiştirirler.Saf maddelerin hal değiştirme
süresince sıcaklıkları değişmez.
Maddelerin zamana bağlı olarak sıcaklıklarının değişimini gösteren grafiklere sıcaklık zaman grafikleri denir.
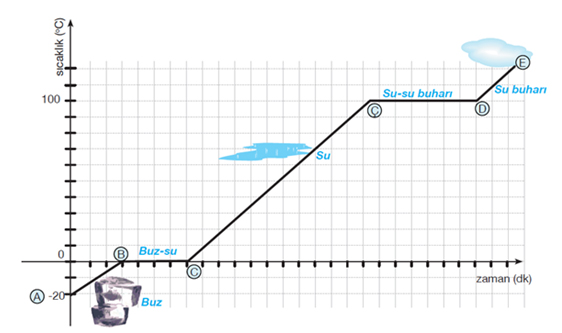
Buzun Isınma Eğrisi
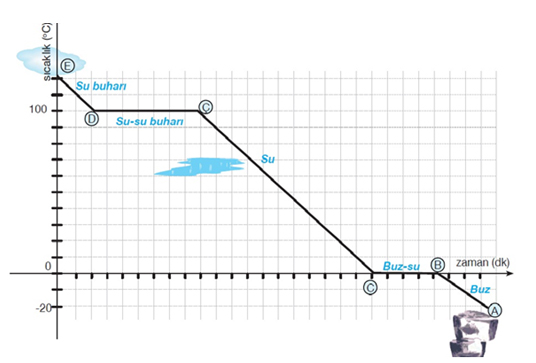
Su Buharının Soğuma Grafiği
Hazırlayan: Osman Gökçe
Bu dokümanın Word
hali |