|
|
MADDENİN HALLERİ VE ISI
ISI VE SICAKLIK
*Isı; sıcaklıkları farklı iki madde arasında alınıp verilen enerjinin adıdır. Bu
durumda sıcaklıkları
eşit iki madde arasında ısı aktarımı gerçekleşmez. Bu iki maddeden birinin
sıcaklığının diğerinden
farklı olması hâlinde, sıcaklığı yüksek olan maddeden sıcaklığı düşük olan
maddeye enerji aktarılır ve aktarılan bu enerjiye ısı adı verilir.
(Not: Isı bir enerji çeşididir, fakat sıcaklık bir enerji çeşidi değildir.)
*Aynı maddenin farklı kütleleri düşünüldüğünde, kütlesi fazla olan madde daha
fazla sayıda tanecik içerir. “Maddelerin aynı sıcaklığa ulaşması için kütlesi
fazla olan maddeye daha fazla ısı aktarılması gerekir.”
*Maddeyi oluşturan tanecikler çarpışarak birbirlerine enerjilerini aktardıkları
için her tanecik farklı enerjiye sahip olabilir ve her çarpışmada da enerjileri
değişebilir.
*Bir maddenin sıcaklığının ölçümünde o maddeyi oluşturan taneciklerin hepsi rol
oynar. Taneciklerin enerjileri birbirinden farklı olduğu için sıcaklık ölçümü
taneciklerin ortalama hareket enerjileri ile ilişkilidir. Taneciklerin ortalama
hareket enerjilerinin göstergesi ise sıcaklık olarak adlandırılır.
Sıcaklık termometre ile ölçülür. (Not: Sıcaklık termometre ile ölçülürken ısı
kalorimetre kabı ile ölçülür.)
*Termometre sıcaklığı ölçülen maddelerin hangisinin hareket enerjileri ile
ilgili bilgi verir. Termometrede sıcaklık 0 0 C` yi gösterdiğinde o maddeyi
oluşturan taneciklerin hareket enerjisi sıfır değildir.
*Termometrelerdeki sıvı seviyesinin yükselip alçalması, haznedeki sıvının
ısındığında genleşmesi ve soğuduğunda büzülmesi ile ilgilidir.
*Bir madde ne kadar çok tanecikten oluşuyorsa toplam hareket enerjisi de o kadar
fazladır. Bu durumda tanecik sayısı fazla olanlar başka bir maddeye daha çok
enerji aktarabilir.(Not: O halde sıcaklık madde miktarına bağlı değilken, ısı
madde miktarına bağlıdır.)
*Farklı sıcaklıklardaki iki maddeden fazla miktarda olanı daha fazla tanecik
içerir ve sıcaklığı düşük olsa bile toplam hareket enerjisi daha fazla olabilir.
Bu sayede, başka bir maddeye daha fazla enerji aktarabilir. (Not: Taneciklerin
toplan enerjisine ısı, ortalama hareket enerjilerinin göstergesine de sıcaklık
diyebiliriz.)
ENERJİ DÖNÜŞÜMÜ VE ÖZISI
*Isı bir enerji çeşidi olduğuna göre maddelerin ısınması da enerji aktarımı ile
gerçekleşir.
*Bir gram maddenin sıcaklığını 1 0C arttırmak için gerekli ısı miktarına o
maddenin öz ısısı denir.
*Isı birimi olan “kalori” suyun öz ısısı esas alınarak tarif edilmiştir. 1 g
suyun sıcaklığını1 0C arttırmak için gerekli ısı miktarı 1 kaloridir.
*Öz ısı cal/g 0C veya J/g 0C birimleriyle ifade edilir.(1 cal=4,18 joule ise
suyun öz ısısı 4,18 J/g 0C olur)
* Öz ısı madde miktarına bağlı olmayıp maddenin cinsine bağlıdır ve tüm maddeler
için farklıdır. Bu yüzden öz ısı maddeler için ayırt edici bir özelliktir ve c
sembolü ile gösterilir.
MADDENİN HALLERİ VE ISI ALIŞVERİŞİ
*Maddeyi oluşturan tanecikler birbirlerine uyguladıkları çekim kuvvetleri
sayesinde bir arada
durur. Bu tanecikler arasındaki çekim kuvveti çok zayıf iken zıt yüklü iyonları
ve moleküldeki
atomları bir arada tutan çekim çok kuvvetlidir. Yani madde ısıtıldığında
taneciklerin birbirinden
ayrılmasıyla madde hal değiştirebilir, fakat ısıtılan bir bileşik elementlerine
ayrılmaz.
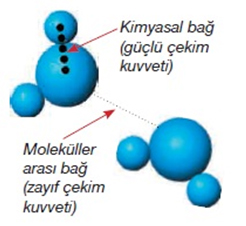
*Tanecikler arasındaki çekim kuvvetinin büyüklüğü maddenin fiziksel hâlini
belirler. Taneciklerin enerjisi arttığında tanecikler birbirinden uzaklaşır ve
buna bağlı olarak çekim kuvveti azalır.
Bir maddede katı halden gaz hale doğru gidildikçe:
- Tanecikler birbirinden uzaklaşır.
- Tanecikler arasındaki çekim kuvveti azalır.(Gazlarda yok denecek kadar az)
- Taneciklerin hareket enerjisi artar ve tanecikler hızlanır.
- Tanecikler düzensizleşir. Şekil, hacim gibi özellikler ortadan kalkar.
*Maddeye ısı aktarıldığında taneciklerin enerjisi artacağından tanecikler
arasındaki mesafe de artacak ve çekim azalacaktır.
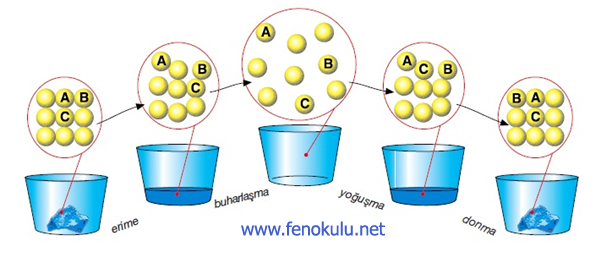
ERİME – DONMA ve BUHARLAŞMA – YOĞUŞMA ISISI
* Katı maddeler erirken çevresinden ısı alır ve alınan ısıyı erime sıcaklığına
gelmek ve tamamen erinmek için kullanırlar.
*Katı madde erimeye başladığı an sıcaklık bir süre sabit kalır, çünkü alınan ısı
katının tamamen erimesi için kullanılır. Sıcaklığın sabit kaldığı bu sürede
verilen ısı o maddenin erime ısısıdır.
*Erime ısısı erime sıcaklığındaki 1 gram saf katı maddeyi sıvı hâle geçiren
ısıdır. Her madde için farklı olduğundan maddeler için ayırt edici bir
özelliktir ve Le gösterilir. Birimi J/g dır.
* Maddenin donmak için dışarıya vermesi gereken ısıya ise donma ısısı denir.
Madde donarken geçen sürede sıcaklık yine sabit kalır. Madde erimek için aldığı
ısı ne kadarsa, donmak için aynı ısıyı geri vermek zorundadır: Bu yüzden erime
ısısı donma ısısına eşittir. (Le =Ld)
* Maddenin erimeye başladığı sıcaklığa erime noktası, donmaya başladığı
sıcaklığa ise donma noktası denir. Erime ve donma noktası maddeler için ayırt
edici bir özelliktir. Aynı madde için erime ve donma noktası birbirine eşittir.
(Erime noktası = Donma noktası) Örneğin su sıfırın üstünde sıvı, sıfırın altında
katıdır.(buz)
* Aktarılan ısı kütle ile doğru orantılı olarak artar veya azalır. O halde bir
miktar maddeyi eritmek için gerekli ısı; Q= m.Le ile donması için dışarı vermesi
gereken ısı Q= m.Ld ile hesaplanır.
*Sıvı haldeki madde buharlaşma sıcaklığına geldiğinde sıcaklık sabit kalır.Çünkü
verilen ısı maddenin tamamının gaz hale geçmesi için harcanmıştır.
* Kaynama sıcaklığındaki 1 g saf sıvıyı, aynı sıcaklıktaki 1g buhar hâline
getirmek için gerekli
ısıya buharlaşma ısısı denir. Sıvılar buharlaşırken aldıkları ısıyı yoğuşurken
geri verirler. Bu sebeple buharlaşma ısısı yoğuşma ısısına eşittir. Buharlaşma
ısısı Lb, yoğuşma ısısı Ly şeklindedir ve Lb=Ly dir.
* Farklı maddeler farklı buharlaşma - yoğuşma ısısına sahiptir. Bu sebeple
buharlaşma - yoğuşma ısıları da maddeler için ayırt edici bir özelliktir.
* Sıvıların buharlaşması için gereken ısı miktarı kütleleriyle doğru
orantılıdır. Kaynama sıcaklığındaki “m” gram sıvıyı buharlaştırmak için gerekli
ısı Q= m.Lb bağıntısı ile , “m” gram buharın yoğuşarak sıvı hâle geçmesi için
çevresine verdiği toplam enerji miktarı Q= m.Ly bağıntısı ile hesaplanır.
* Maddelerin buharlaşırken çevreden ısı alması ve yoğuşurken çevreye ısı
vermesi, günlük hayatta birçok alanda karşımıza çıkmaktadır. Buzdolabına konulan
yiyeceklerin sulanması, yazın yolların ve mağaza önlerinin sulanması,
kesildikten sonra güneşe konulan karpuzun soğuması, kolonya dökülen elin bir
müddet sonra serinlemesi buna örnektir.
* Saf maddelerin belirli bir erime ve kaynama noktaları vardır, fakat saf
olmayan maddelerin belirli bir erinme ve kaynama noktaları yoktur. Bu yüzden saf
olmayan maddelerde kaynama süresince sıcaklık sabit kalmaz. Örneğin suya tuz
atıldığında oluşan karışımda sodyum ve klor iyonları su moleküllerinin arasına
girer ve suyun donma noktasını düşürür. Kışın yollara tuz dökülmesinin sebebi
budur.
*Sıvılara karışmış olan katkı maddeleri ise sıvının kaynama sıcaklığını
yükseltir. Örneğin suya tuz atıldığında kaynama noktası yükselecektir. Bu yüzden
yemeklere atılan tuz, piştikten sonra atılırsa daha mantıklı bir karar verilmiş
olacaktır.
ISINMA – SOĞUMA EĞRİLERİ
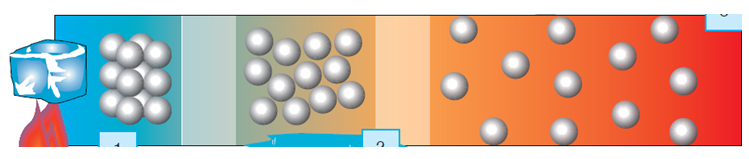
Şekildeki ısı kaynağı değiştirildiğinde,
*Taneciklerin birbirlerinden ayrılma süresi değişir. Daha fazla ısı verildiğinde
tanecikler birbirlerinden daha kolay ayrılacaktır.
*Erime ve kaynama süresi değişir. Daha güçlü bir ısı kaynağıyla buz daha çabuk
eriyip kaynamaya başlayacaktır.
* Erime ve kaynama sıcaklıkları değişmez. Isıtıcı ne kadar büyük olursa olsun su
0oC de erir, 100 oC de kaynar. Su miktarının artması ya da azalması da erime ve
kaynama noktasını değiştirmez.
* Erime ve buharlaşma ısıları değişmez. Erime noktası, kaynama noktası, erime
ısısı ve buharlaşma ısı gibi özellikler ayırt edici özellikler olduğundan madde
miktarına bağlı olmayıp, maddenin türüne bağlıdır.
*Bildiğimiz gibi 0 OC`ta su donar, buz erir; 100 OC`ta su kaynar, su buharı
yoğuşur. Suyun miktarı değişse bile bu değerler değişmez.
Word Halini
İndir
|
|
|
Bu konu 81473 kez okundu |
|
Bu konuyu Site Admini Ekledi |