MADDENİN HALLERİ ve ISI
Isı sıcaklıkları farklı olan maddeler arasında alınıp verilen enerjidir. Sıcaklıkları farklı olan maddeler, birbirine temas ettiğinde sıcak maddeden soğuk maddeye doğru sıcaklıklar eşitleninceye kadar ısı akışı olur. Sıcaklıkları eşit olan maddeler arasında ısı alışverişi gerçekleşmez.
Isı ve Sıcaklık Arasındaki Farklar:
*Isı bir enerjidir, sıcaklık bir enerji değildir.
*Isı, madde taneciklerinin toplam enerjisidir. Sıcaklık madde taneciklerinin ortalama enerjilerinin göstergesidir.
*Isı madde miktarına bağlıdır. Sıcaklık madde miktarına bağlı değildir.
*Isı birimi kalori (cal) ya da Joule(J), sıcaklık birimi 0C`dir.
*Isı kalorimetre kabı ile sıcaklık termometre ile ölçülür.
A) ÖZISI
Etkinlik: Su ve Zeytinyağının Sıcaklığı Nasıl Değişir?
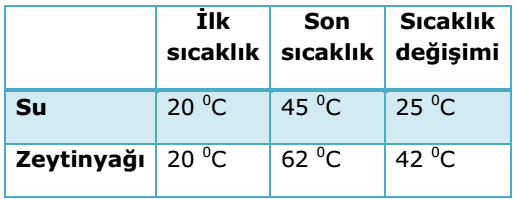
Özdeş ısıtıcı ile eşit süre ısıtılan (eşit miktarda ısı verilen) eşit kütledeki su ve zeytinyağının sıcaklık değişimi farklı oldu. Sıcaklık değişimi maddenin cinsine bağlı olarak değişir.
1 gram maddenin sıcaklığını 1 0C değiştirmek için alınan ya da verilen ısıya öz ısı denir. Birimi J/g0C ‘dir. “c” harfi ile ifade edilir. Öz ısı maddeler için ayırt edici bir özelliktir.
Isı birimi olan kalori (cal) suyu öz ısısı esas alınarak tarif edilmiştir. Gram suyun sıcaklığını 1 0C artırmak için gerekli olan ısı miktarı 1 kaloridir.
1 cal = 4,18 J

Sıvılı termometrelerde yağ yerine civa kullanılmasının nedeni özısısının küçük olmasıdır.
Peynirli gözleme patatesli gözlemeden çabuk soğur. Çünkü özısısı küçüktür.
Elektrikli radyatörlerde su yerine yağ kullanılmasının nedeni yağın öz ısısının küçük olmasıdır.
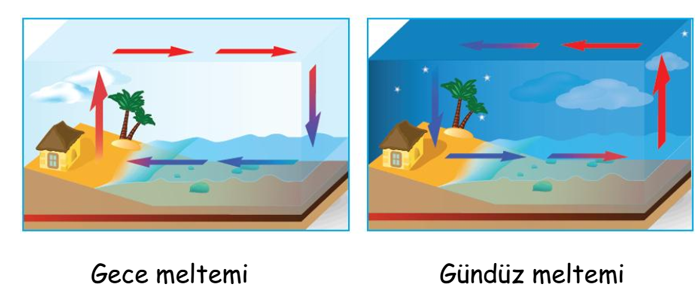
Denizler karalara göre geç ısınır, geç soğur. Bunun nedeni suyun özısısının büyük olmasıdır. Sular geç ısındığı için denizden karaya doğru serin rüzgârlar eserken (gündüz meltemi), akşamları karalar çabuk soğuyup sular geç soğuduğu için bu sefer rüzgâr (gece meltemi) karadan denize doğru oluşmaktadır.
B) ISI ALIŞVERİŞİ ve SICAKLIK DEĞİŞİMİ
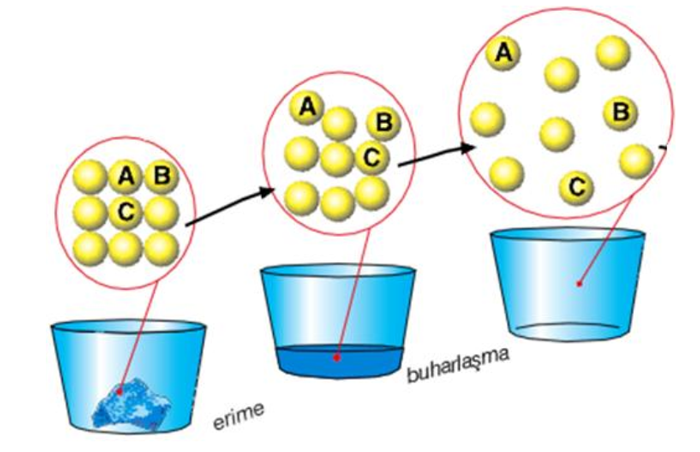
Madde ısı aldığında;
Taneciklerinin enerjisi artar.
Tanecikleri arasındaki mesafe artar.
Tanecikleri arasındaki çekim kuvveti azalır.
Tanecikler düzensizleşir.
1) Isı – Özısı İlişkisi
Etkinlik: Isı – Özısı İlişkisi
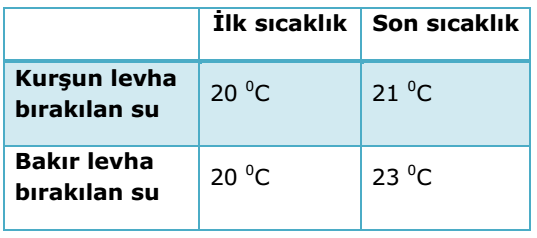
Aynı sıcaklıktaki kurşun ve bakır levha soğuk sulara bırakıldığında özısısı büyük olan bakır levha daha fazla sıcaklık artışına neden oldu.
Öz ısısı büyük olan maddeler soğurken daha çok ısı vermektedir. Çünkü bu maddeler ısıtılırken daha fazla ısı almaktadır. Isı ile özısı doğru orantılı olarak değişmektedir.
2) Isı – Kütle İlişkisi

Farklı kütlelerdeki aynı tür maddeleri aynı sıcaklığa getirmek için, kütlesi büyük olanın daha uzun süre ısıtılması veya daha çok ısı veren ısı kaynağı kullanılması gerekir. Isı ile maddenin kütlesi arasında doğru orantı vardır.
3) Isı – Sıcaklık İlişkisi

Maddeye verilen ısı miktarı arttıkça sıcaklık değişimi daha fazla olur. Bir çaydanlık su ısıtıldığında sıcaklığı 10 0C artıyorsa, iki kat şiddetli yanan ocakta sıcaklığı 20 0C artar. Isı ile sıcaklık değişimi arasında doğru orantı vardır.
4)Kütle – Sıcaklık İlişkisi
Farklı kütledeki aynı tür maddelere eşit miktarda ısı verildiğinde, kütlesi fazla olanın sıcaklık değişimi daha az olur. Kütle ile sıcaklık değişimi arasında ters orantı vardır.
Özısısı c olan m kütleli bir cismin sıcaklığını Δt kadar artırmak için verilmesi gereken ısıyı (Q) aşağıdaki bağıntı ile hesaplarız.
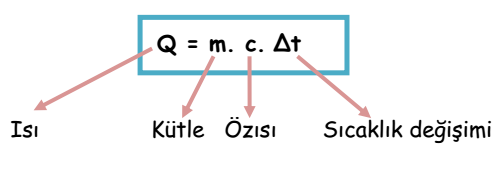
Isı Kütle Özısı Sıcaklık değişimi
5) Isı Alışverişi
Sıcaklıkları farklı olan maddeler, birbirine temas ettiğinde sıcak maddeden soğuk maddeye doğru sıcaklıklar eşitleninceye kadar ısı akışı olur. Bu sıcaklığa denge sıcaklığı denir. Denge sıcaklığı kısaca td ile gösterilir.
Farklı sıcaklıktaki aynı maddeden yapılmış iki cisim birbirine temas ettiğinde;
Kütleleri eşit ise, son sıcaklık toplam sıcaklığın yarısıdır.
Kütleler eşit değilse, son sıcaklık kütlesi fazla olanınkine daha yakındır.
Örneğin 20 0C ve 40 0C sıcaklığındaki aynı maddeden yapılmış iki cisim birbirine temas ederse,
*Kütleler eşit ise, son sıcaklık 40+20/2 =30 0C olur.
*Sıcak olanın kütlesi fazla ise son sıcaklık 30 0C ile 40 0C arasında olur
*Soğuk olanın kütlesi fazla ise sıcaklık 200C ile 30 0C arasında olur.
Denge Sıcaklığının Hesaplanması
Isı alış verişi farklı maddeden yapılmış cisimler arasında gerçekleşiyorsa denge sıcaklığını hesaplamak için aşağıdaki bağıntından yararlanılır.
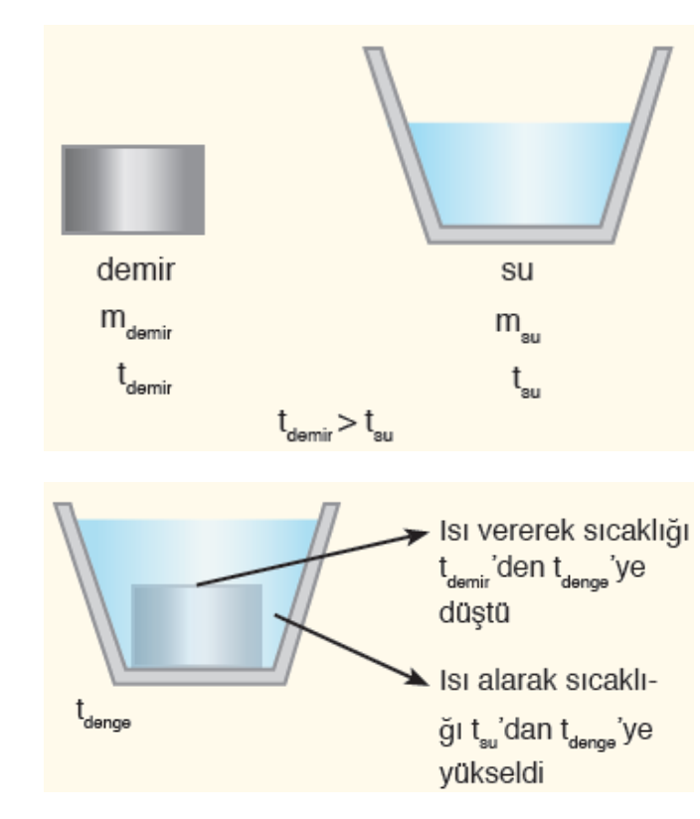
Qverilen=mdemir . cdemir .(tdemir – tdenge)
Qalınan=msu . csu .(tdenge – tsu)
Alınan ısı verilen ısıya eşit olduğuna göre
Qalınan = Qverilen
denkleminden denge sıcaklığı hesaplanabilir.
C) MADDENİN HALLERİ ve ISI ALIŞVERİŞİ
1) Hal Değişimi ve Isı Alışverişi
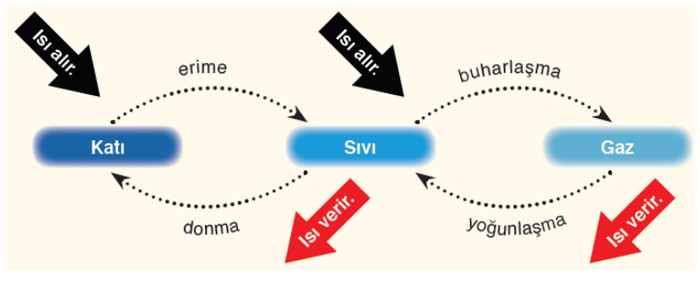
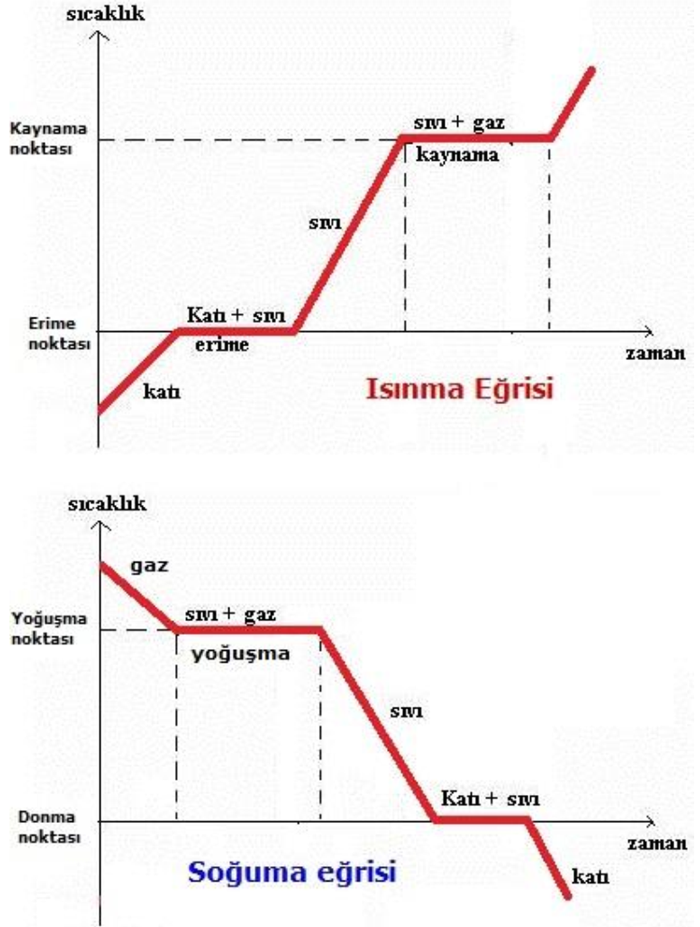
Hal değişimi ısı alışverişi sonucu gerçekleşen bir olaydır. Saf bir maddenin hal değiştirebilmesi için hal değişim sıcaklığına ulaşması gerekir. Hal değişimi esnasında sıcaklık sabit kalır. Alınan ısı hal değişimi için harcanır.
2) Hal Değişim Isısı
Erime sıcaklığındaki 1 gram saf katının sıvı hale gelmesi için gerekli ısıya erime ısısı denir. Birimi J/g`dır. Le ile gösterilir.
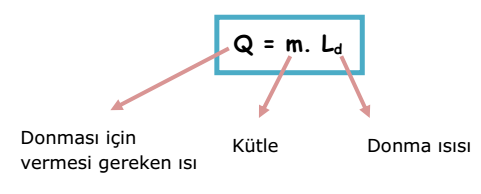
Donma sıcaklığındaki 1 gram saf sıvının katı hale gelmesi için çevreye verdiği ısı miktarına donma ısısı denir. Birimi J/g`dır. Ld ile gösterilir.
Farklı maddelerin erime ve donma ısıları birbirinden farklıdır. Erime ve donma ısısı maddeler için ayırt edici özelliktir.
Katı bir madde erirken ne kadar ısı alırsa aynı ısıyı katı hale geçerken de çevresine verir. Bu sebeple aynı tür maddelerin erime ısısı donma ısısına eşittir.
Erime ısısı = Donma ısısı
Hal değişimi için gerekli olan ısı kütle ile doğru orantılı olarak değişir.
m kütleli maddenin erimesi için gerekli olan ısı miktarı;
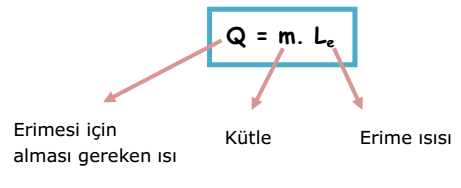
m kütleli maddenin donması için çevreye verdiği ısı miktarı;
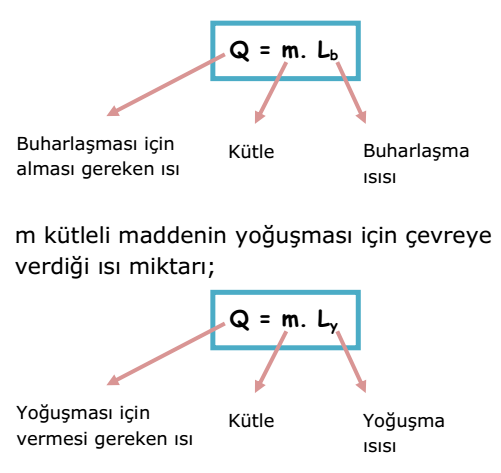
Kaynama sıcaklığındaki 1 gram saf sıvının gaz hale gelmesi için gerekli ısıya buharlaşma ısısı denir. Birimi J/g`dır. Lb ile gösterilir.
Yoğuşma sıcaklığındaki 1 gram saf gazın sıvı hale gelmesi için çevreye verdiği ısı miktarına yoğuşma ısısı denir. Birimi J/g`dır. Lb ile gösterilir.
Buharlaşma ve yoğuşma ısısı da maddeler için ayırt edici özelliktir.
Sıvı bir madde buharlaşırken ne kadar ısı alırsa aynı ısıyı sıvı hale geçerken de çevresine verir. Bu sebeple aynı tür maddelerin buharlaşma ısısı yoğuşma ısısına eşittir.
m kütleli maddenin yoğuşması için çevreye verdiği ısı miktarı;
Buharlaşma ısısı = Yoğuşma ısısı
NOT: Maddenin saflığı bozulduğunda erime noktası düşer, kaynama noktası yükselir.
3)Hal Değişim Grafiği
4)Günlük Yaşamda Hal Değişimi ve Isı Alışverişi
*Yazın dükkânların önüne su serpilmesinin nedeni, buharlaşan suyun yerden ısı alması ve ortamı serinletmesidir.
*Elimize kolonya döküldüğünde bir süre sonra serinlik hissetmemizin nedeni kolonyanın buharlaşırken elimizden ısı almasıdır.
*Güneşe bırakılan kesilmiş karpuzun soğumasının nedeni, buharlaşan sıvının karpuzdan ısı almasıdır.
*Testideki suyun soğuk kalmasının nedeni, testiden sızan suyun buharlaşırken testiden ısı almasıdır.
*Terleme ile vücut sıcaklığının dengelenmesinin nedeni, buharlaşan terin vücudumuzdan ısı almasıdır.
*Meyve sebze depolarına su konulmasının nedeni suyun donarken ortama ısı vermesi ve ortamı ısıtmasıdır.
*Kar yağarken havanın yumuşamasının nedeni, kar oluşurken su taneciklerinin ortama ısı vermesidir.
*Klima ve soğutucularda hızlı buharlaşma ile ortam soğutulurken, hızlı yoğuşma ile ortam ısıtılır.
Mustafa ÇELİK Yahya Kaptan Ortaokulu Fen Bilimleri Öğretmeni
Bu dokümanın Word hali
|