Çözücü ve çözünen maddelerin birbiri içerisinde iyonlarına veya moleküllerine kadar ayrılmasına çözünme denir.
Bir maddenin moleküllerinin veya iyonlarının, diğer maddenin moleküllerinin veya iyonlarının arasına girmesine çözünme denir.
Çözünme olayında;
▪ Çözücü ve çözünen maddeleri oluşturan tanecikler yani moleküller veya iyonlar çözünme olayı gerçekleşmeden önce birbirlerine çok yakındır.
▪ Çözücü maddelerin tanecikleri ile çözünen maddelerin tanecikleri yani molekülleri veya iyonları etkileşir.
▪ Çözücü ve çözünen maddenin tanecikleri yani molekülleri veya iyonları arasında elektron alış verişi veya ortaklaşması gerçekleşmediği için çözücü ve çözünen madde sadece fiziksel değişime uğrar, kimyasal değişime uğramaz ve maddelerin kimliklerinde değişme meydana gelmez.
▪ Çözünme sonrasında, çözücü ve çözünen tanecikleri birbirlerinin etrafını sardığı için çözücü ve çözünen tanecikleri çözeltinin her tarafında eşit miktarda bulunur.
▪ Çözücü madde tanecikleri, çözünen madde taneciklerinin etrafını sardığı için çözücü maddenin tanecikleri de birbirinden ayrılır.
▪ Çözünen madde moleküler yapılı ise, çözücü maddenin molekülleri, çözünen maddenin moleküllerinin arasına girerek çözünen maddenin moleküllerinin etrafını sarar ve çözünen maddenin moleküllerine kadar ayrılmasını sağlar. Ayrılan moleküller çözücünün her tarafına eşit oranda dağılır.
▪ Çözünen madde iyonik yapılı ise, çözücü maddenin molekülleri, çözünen maddenin (+) ve (–) iyonlarının arasındaki iyonik bağı zayıflatır ve (+) ve (–) iyonlar birbirinden ayrılır. Çözücü maddenin molekülleri, ayrılan (+) ve (–) iyonların arasına girerek bu iyonların etrafını sarar ve çözünen maddenin iyonlarına kadar ayrılmasını sağlar. Ayrılan iyonlar çözücünün her tarafına eşit oranda dağılır.
ÖRNEKLER :
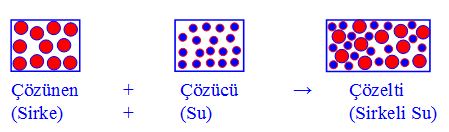
1- Su–sirke çözeltisinde, çözünen olan sirke, moleküler yapılı bileşiktir. Çözücü olan su molekülleri, çözünen olan sirke moleküllerinin etrafını sararak sirke moleküllerinin birbirinden uzaklaşmasını (ve çözücünün her tarafına dağılmasını) yani çözünmesini sağlar.
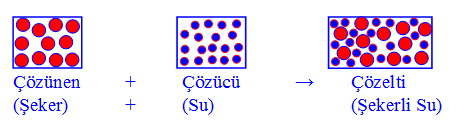
2- Su–şeker çözeltisinde, çözünen olan şeker, moleküler yapılı bileşiktir. Çözücü olan su molekülleri, çözünen olan şeker moleküllerinin etrafını sararak şeker moleküllerinin birbirinden uzaklaşmasını (ve çözücünün her tarafına dağılmasını) yani çözünmesini sağlar.
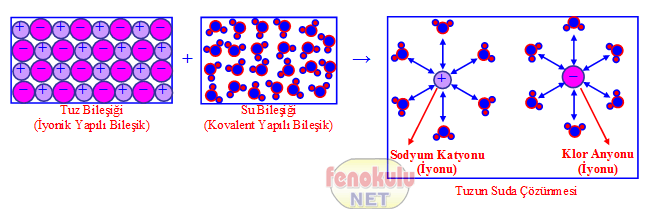
3- Su–tuz çözeltisinde, çözünen olan tuz iyonik yapılı bileşiktir. Çözücü olan su molekülleri, çözünen olan tuz bileşiğindeki (+) ve (–) iyonlar arasındaki iyonik bağı zayıflatır ve (+) yüklü Na+ iyonu ile (–) yüklü Cl– iyonlarının arasına girerek bu iyonların birbirinden ayrılmasını (ve çözücünün her tarafına dağılmasını) yani çözünmesini sağlar. (Su molekülleri sodyum iyonlarına oksijen, klor iyonlarına hidrojen tarafıyla yaklaşır.).
(NaCl deki iyonik bağı oluşturan elektriksel çekim kuvveti, ortam değişince özellikle su ortamında zayıfladığı için su molekülleri Na ve Cl iyonlarının arasına girer. Tuz kristallerden oluşur. Her bir sodyum atomunun çevresinde altı klor atomu, yine her bir klor atomu çevresinde altı sodyum atomu vardır.).
|